近日,浙江清华长三角研究院张强强课题组与复旦大学脑科学转化研究院/附属华山医院迟喻丹课题组合作在Nature子刊 《Nature Cancer 》(《自然-癌症》)上发表了题为:Dura immunity configures leptomeningeal metastasis immunosuppression for cerebrospinal fluid barrier invasion 的研究论文,首次报道了脑膜转移瘤中枢边界屏障动态跃迁机理。

大脑中枢的边界构成复杂,涵盖了颅骨、脑膜、脉络丛及血管旁间隙等关键解剖学要素,而脑脊液则作为这一边界区域内至关重要的物质交换媒介,在其间潺潺流动。在正常生理条件下,中枢边界被多种精密的屏障系统所守护,这些屏障犹如精密的过滤器,确保外周环境中的物质与细胞能够经过严格筛选后,方得进入脑脊液,从而维持了脑脊液的低细胞浓度与低蛋白含量特性。然而,越来越多的科学证据揭示了在病理条件下中枢边界屏障稳定性的受损情况,这些屏障可能转变为活跃的中枢-外周交互界面,加速疾病的恶化进程。此外,脑部作为原发性及转移性癌症的高风险区域,因肿瘤的生长、免疫细胞的募集以及血管的异常改变,形成了一个独特的病理性微生态系统。这一癌性微生态系统对中枢边界屏障稳定性的影响及其潜在机制,是当前脑癌研究领域亟待解决的关键难题,对于深入理解疾病进展及探索有效治疗策略具有重要意义。
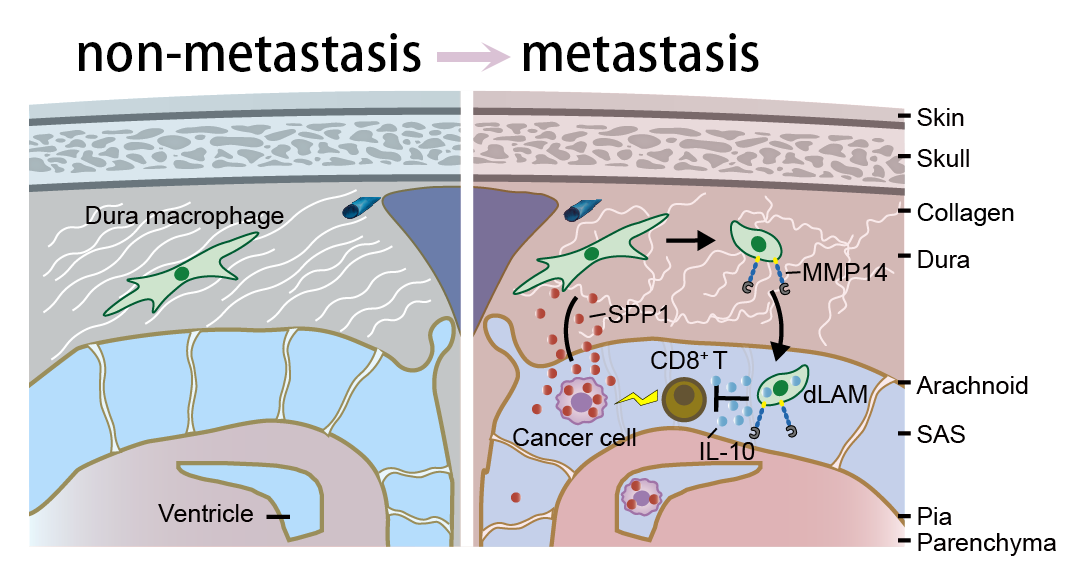
软脑膜转移瘤(leptomeningeal metastasis)是一种严重的恶性肿瘤,肿瘤细胞侵入中枢边界的蛛网膜下腔及脑脊液中,这一现象在肺癌、乳腺癌和黑色素瘤患者中尤为常见。罹患此症的患者面临严峻的健康挑战,自然生存期通常仅为两个月左右,且伴随剧烈头痛、恶心、呕吐、视力模糊、认知功能衰退等一系列神经系统症状,严重降低了患者的生活质量。尽管临床上已尝试采用放疗、化疗和靶向治疗等多种手段,但治疗效果依然不尽如人意。2020年,迟喻丹首次揭示了软脑膜转移患者脑脊液的微环境特征,并发现肿瘤细胞能通过竞争脑脊液中的微量元素铁离子,与巨噬细胞争夺生存优势。这一发现为理解软脑膜转移的免疫治疗开辟了新视角。然而,软脑膜转移瘤紧邻中枢边界,引发脑脊液中免疫细胞的大量浸润和细胞因子的上调,但其对中枢边界的具体影响机制仍笼罩在迷雾之中。
在这项最新研究中,浙江清华长三角研究院张强强课题组与复旦大学脑科学转化研究院/附属华山医院迟喻丹课题组合作,深入剖析了软脑膜转移瘤进程中,中枢边界硬脑膜细胞组分和细胞外基质组分的重塑变化,并特别关注了脑膜巨噬细胞如何突破受损的硬脑膜屏障,迁移到脑脊液中的动态过程及其调控机制。令人振奋的是,研究发现通过靶向软脑膜转移相关的脑膜来源巨噬细胞,能够有效激活脑脊液中的适应性免疫系统,增强其对肿瘤的监视和攻击能力,从而为软脑膜转移瘤的临床治疗提供了全新的策略。
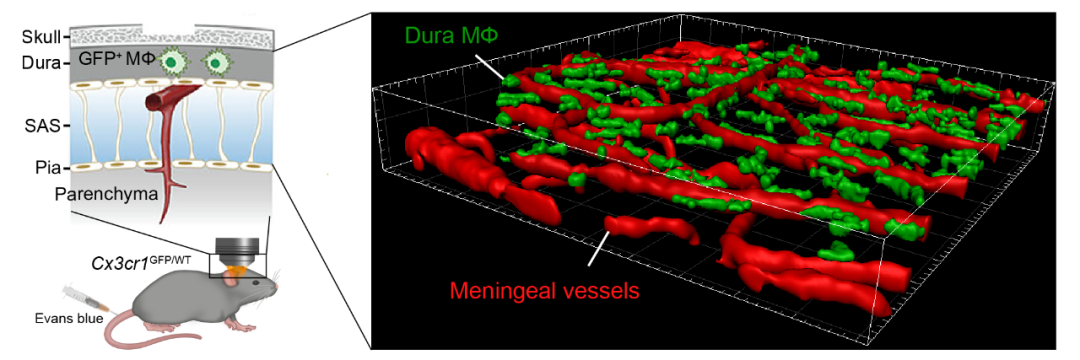
研究团队利用具有高转移倾向性的肿瘤细胞系构建了小鼠模型,并通过骨髓移植、脑驻留巨噬细胞命运追踪实验以及患者脑脊液的单细胞转录组测序数据分析,证实了软脑膜转移瘤发生时脑脊液中存在大量组织驻留型边界相关巨噬细胞(BAM)。进一步,采用体3D双光子长时程成像技术,研究团队观察到硬脑膜中的BAM在软脑膜转移瘤发生时能迁移至脑脊液中(图1)。同时,二次谐波成像技术揭示了硬脑膜胶原结构的破坏,为BAMs迁移提供了物理基础。单细胞转录组测序分析显示,荷瘤小鼠硬脑膜中的BAMs转变为迁移表型,并高表达基质金属蛋白酶MMP14。为了验证MMP14的作用,研究者使用其抑制剂发现其能显著降低脑脊液中巨噬细胞数量,并显著延长小鼠生存期。
进一步的研究中,研究团队利用脑脊液蛋白组学技术,在小鼠的脑脊液中发现了显著上调的分泌型磷酸蛋白1(SPP1)。通过验证,证实SPP1能够增强硬脑膜中BAMs表达基质金属蛋白酶MMP14的能力,从而促进巨噬细胞从脑膜向脑脊液的迁移。为了深入探究脑脊液中BAMs的功能特性,研究团队采用了转录组测序、细胞互作分析、体外T细胞增殖抑制实验以及T细胞功能检测实验等多种手段。这些研究揭示了软脑膜转移相关的BAM能够显著抑制CD8+T细胞的肿瘤杀伤功能。重要的是,研究团队发现通过遗传学方法或小分子药物靶向SPP1-MMP14信号轴,可以有效减少荷瘤小鼠脑脊液中的巨噬细胞数量,并显著提升脑脊液中CD8+T细胞的肿瘤杀伤能力,从而延长荷瘤小鼠的总生存期。这些发现为理解软脑膜转移的机制以及开发针对性的治疗策略提供了重要的科学依据。
复旦大学脑科学转化研究院/附属华山医院迟喻丹研究员和浙江清华长三角研究院生物技术与医药研究所高等模式动物研究中心/浙江全省多维组学与分子酶学重点实验室PI张强强为该论文的通讯作者。复旦大学脑科学转化研究院赵加旭博士和复旦大学附属华山医院临床八年制博士生曾睿为该论文的第一作者。该研究得到国家自然科学基金、科技部重点研发计划、上海市科技创新行动计划等基金的支持和资助。
